
Cure de détox chez les oiseaux marins : élimination du mercure par le sélénium
Le mercure se répand de plus en plus dans la nature et est aujourd’hui considéré comme l’une des substances les plus dangereuses pour la santé et l’environnement. Chez la plupart des organismes il s’accumule le long de la chaîne alimentaire. Les oiseaux marins ont alors une technique particulière pour l’éliminer : le sélénium.
Le mercure, un danger
Le mercure, de symbole Hg est un métal non-essentiel classé au troisième rang sur la liste des substances dangereuses et est considéré comme l’un des métaux les plus préoccupants pour les organismes marins . Le mercure provient de sources naturelles comme l’activité volcanique, et également de l’activité humaine avec les usines ou l’orpaillage. Il peut parcourir de longues distances dans l’atmosphère et atteindre des régions très éloignées des sources d’émissions. En 2003, il a été déclaré comme étant une substance nocive d’importance mondiale. Les effets du mercure sont néanmoins variables car ils dépendent de sa forme moléculaire.

Un peu de chimie est nécessaire pour comprendre le fonctionnement de l’intégration du mercure par les organismes vivants. Le mercure existe sous trois formes chimiques principales : élémentaire (Hg0), sous forme de sel inorganique (HgII), ou lié à un ligand1 organique, toutes ces espèces chimiques étant potentiellement toxiques. Le mercure inorganique divalent (Hg2+) est l’un des éléments de liaison aux groupements thiols2 les plus puissants. Sa toxicité est expliquée par sa capacité à former des complexes stables avec les groupes de protéines sulfhydryle-cystéine (–SH)3, comme de nombreuses enzymes liées aux groupements thiols. Les composés organiques du mercure sont principalement métabolisés4 dans le foie où ils peuvent subir une méthylation5 en méthylmercure (MeHg). Le méthylmercure est une puissante neurotoxine qui s’accumule dans les organismes et se bioamplifie au cours de la chaîne trophique, jusqu’à atteindre des niveaux dommageables pour la santé. Ses effets néfastes sont connus aux niveaux physiologiques, neurologiques, comportementaux et reproductifs.
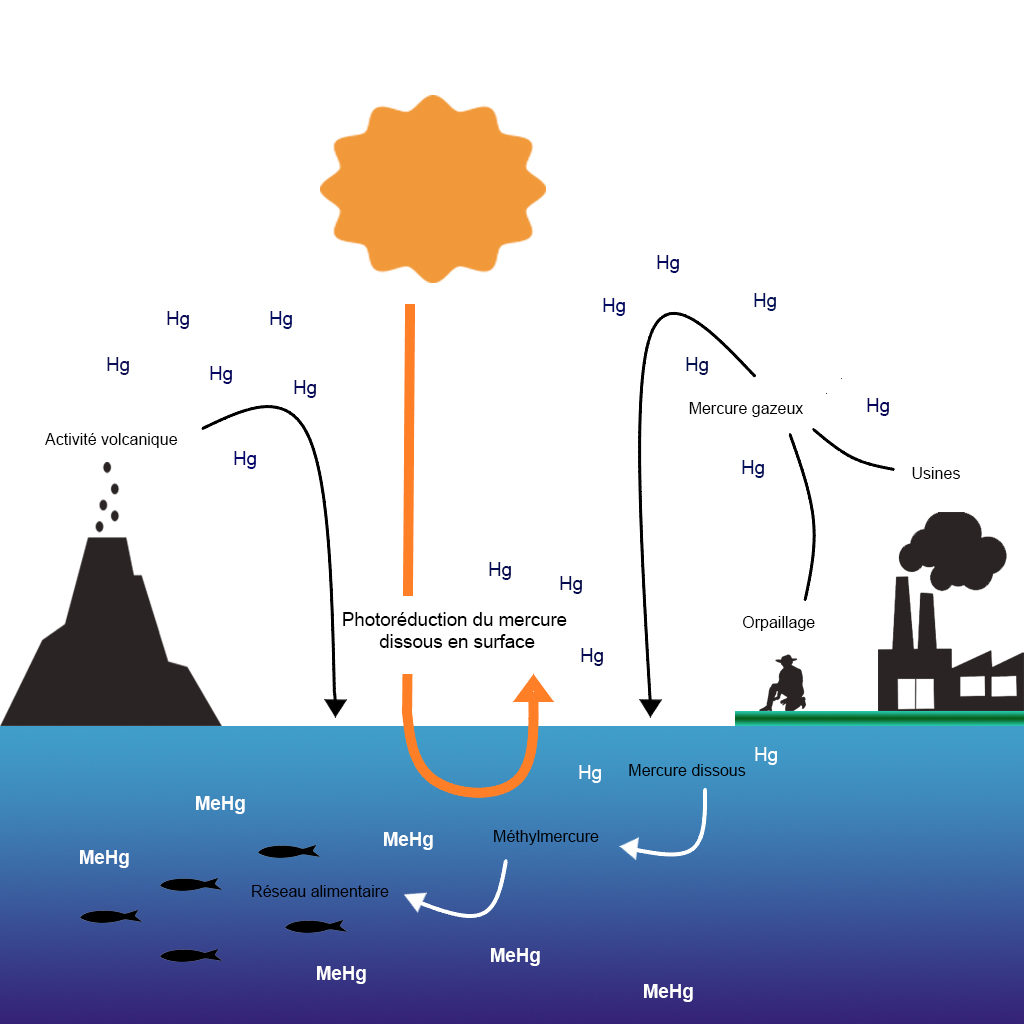
Quelles conséquences pour les oiseaux marins ?
Si les oiseaux marins ne constituent que 3 % de la totalité des oiseaux, ils jouent néanmoins un rôle essentiel dans leur écosystème. Présents sur tous les océans, ils sont de grands prédateurs et sont par conséquent situés tout en haut de la chaîne alimentaire. Il est donc très important de veiller à leur maintient. Chez les oiseaux marins, le mercure peut entraîner une réduction de l’apport alimentaire conduisant à une perte de poids et une faiblesse progressive dans les ailes et les pattes. L’oiseau aura donc des difficultés à voler, marcher, se tenir debout et coordonner ses mouvements musculaires. Au niveau reproducteur, les effets du mercure sont multiples. Ainsi, une dose de 2 ppm conduit à un développement tardif des testicules chez les jeunes mâles, une atrésie6 des gonades et chez les femelles et une baisse de la fertilité. Sur le système nerveux central, le mercure peut provoquer des dysfonctionnements associés à des lésions, particulièrement dans la moelle épinière.
Les oiseaux marins accumulent le mercure principalement via leur alimentation, et l’éliminent par leurs excréments, leur plumage et, chez les femelles, par les œufs. Il ne se contentent donc pas d’absorber le mercure : ils équilibrent la balance entre le taux ingéré et celui éliminé. Durant la synthèse du plumage, le mercure est transporté par le sang vers les plumes en croissance. Une fois leur synthèse terminée, chaque plume devient physiologiquement inerte, non irriguée ce qui empêche toute remobilisation du mercure vers le corps. Ainsi, le renouvellement du plumage constitue une voie de détoxication et d’excrétion du mercure tout à fait efficace, permettant d’éliminer plus de 90% du mercure accumulé dans les tissus internes.La détoxication du mercure dans les tissus internes est permise par des protéines, notamment par les métallothionéines7. Ces protéines sont riches en cystéine et donc en groupement thiols qui permettent la liaison à différents métaux comme le cuivre ou le zinc pour lesquels elles jouent un rôle homéostatique8. Pour les métaux non-essentiels comme le cadmium ou le mercure, elles vont également permettre une plus haute tolérance de l’organisme à ces éléments toxiques à de faibles concentrations. Elles protègent les cellules en agissant comme antioxydants et en piégeant les radicaux libres, mais également en liant les métaux lourds, les neutralisant et les enfermant à l’intérieur de la cellule.
L’action du sélénium pour la détoxication
La détoxication du mercure est également permise via son interaction avec le sélénium (Se) qui permet de transformer le méthylmercure très toxique en séléniure de mercure, inerte chimiquement. Du fait de sa forte affinité pour le sélénium, cette déméthylation a lieu principalement dans le foie des oiseaux marins (mais également des mammifères marins), conduisant à une proportion de mercure inorganique majoritaire dans leur foie. La production de séléniure de mercure (ou tiemannite) se caractérise par un ratio équimolaire (1:1) entre les deux éléments. La présence de tiemannite indique que le processus de détoxication du méthylmercure par le sélénium est actif, ce qui se traduit par leur coaccumulation.. La présence de Se semble également avoir un effet inhibiteur de la toxicité du Hg au niveau des activités enzymatiques.
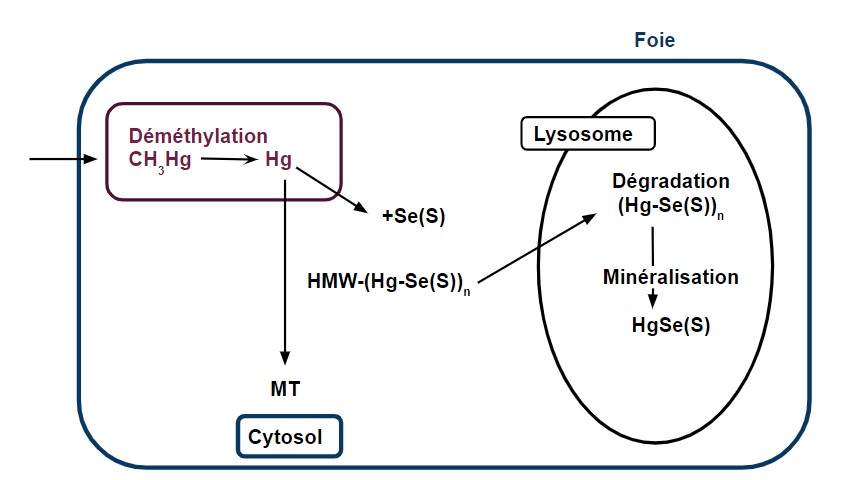
Le méthylmercure (MeHg) absorbé par l’alimentation est transformé en Inorg-Hg par la microflore intestinale, et le sélénium. L’Inorg-Hg résultant se lie aux Métallothionéines (MT) et forme un complexe Hg-Se équimolaire, puis se lie aux substances de haut poids moléculaire (HMW) dans le foie. Le complexe Hg-Se lié aux protéines est supposé être le précurseur du HgSe cristallin. On suppose que les molécules de glutathion (GSH) se fixent au HgSe pour le rendre soluble et que le complexe résultant se lie à une protéine spécifique. De plus, il est connu que la digestion des HMW liés au mercure et au sélénium par la protéase provoque la formation de mercure et de sélénium insolubles.
Pourquoi cette détoxication n’est-elle pas toujours possible ?
Le Se est en partie essentiel et doit être présent à des niveaux appropriés (environ 30 mg/ kg de poids sec) pour maintenir la fonction physiologique dans le corps animal. En dessous d’un certain ratio Se:Hg, les liaisons entre le sélénium et le mercure ne se forment pas. Malgré ses effets protecteurs, le sélénium, lorsqu’il est présent en grande quantité, peut engendrer des anomalies comportementales, une chute du succès reproducteur et dans les cas extrêmes, la mort. Chez certains oiseaux, une concentration en sélénium entre 19 et 130 ppm dans le foie a été associé avec le fait que 40% des oiseaux adultes produisaient un embryon mort. De fortes concentrations en sélénium ont été reportées dans les œufs et les tissus d’oiseaux marins comme les guillemots marmettes. Chez la petite Sterne (Sterna antillarum), 80% des œufs testés dans le Nord de l’Amérique avaient une concentration en Se supérieure à celle considérée comme saine.

L’étude de Hutton en 1981 illustre déjà bien se principe. En mesurant la quantité de mercure et de sélénium dans le foie de Pie de mer Haematopus ostralegus, un huîtrier, ce rapport était déjà observé. En effet, la concentration en sélénium était alors de 12,8 µg/g pour seulement 0,73 µg/g de mercure. Le ratio Se:Hg était donc de 17,53, bien loin du ratio molaire 1:1 obtenu chez les mammifères marins. En 1977, Philips notait que les mollusques marins (dont se nourrit la Pie de mer) étaient capables d’accumuler de grandes quantité de mercure. Le niveau de mercure bas chez la Pie peut s’expliquer par le fait qu’il existe d’autres moyens de détoxication du Hg, ne nécessitant pas de Se.
Comment expliquer les différences interspécifiques ?
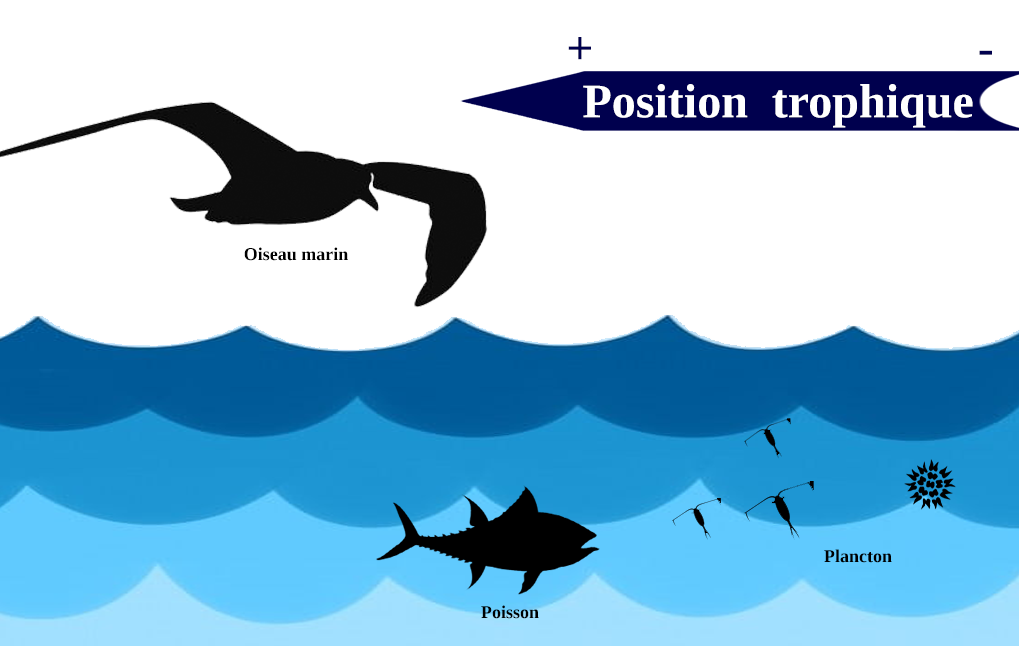
Les différences interspécifiques, c’est-à-dire entre différentes espèces, de l’exposition au mercure sont le résultat du régime alimentaire. Le mercure étant amplifié efficacement dans les réseaux trophiques, les proies de haut niveau trophique comme les poissons et les céphalopodes vont inévitablement présenter de plus fortes concentrations en mercure que les crustacés ou le plancton. Ces explications sont bien corrélées par la figure ci dessus, où les concentrations de Hg dans les plumes augmentent dans cet ordre : consommateurs de crustacés ⩽ poissons ⩽ céphalopodes ⩽ charognes. Les eaux mésopélagiques sont celles qui contiennent le plus de méthylmercure. Par conséquent, les proies comme les céphalopodes, qui vivent dans ces eaux, seront plus contaminées, entraînant une plus forte contamination du consommateur.
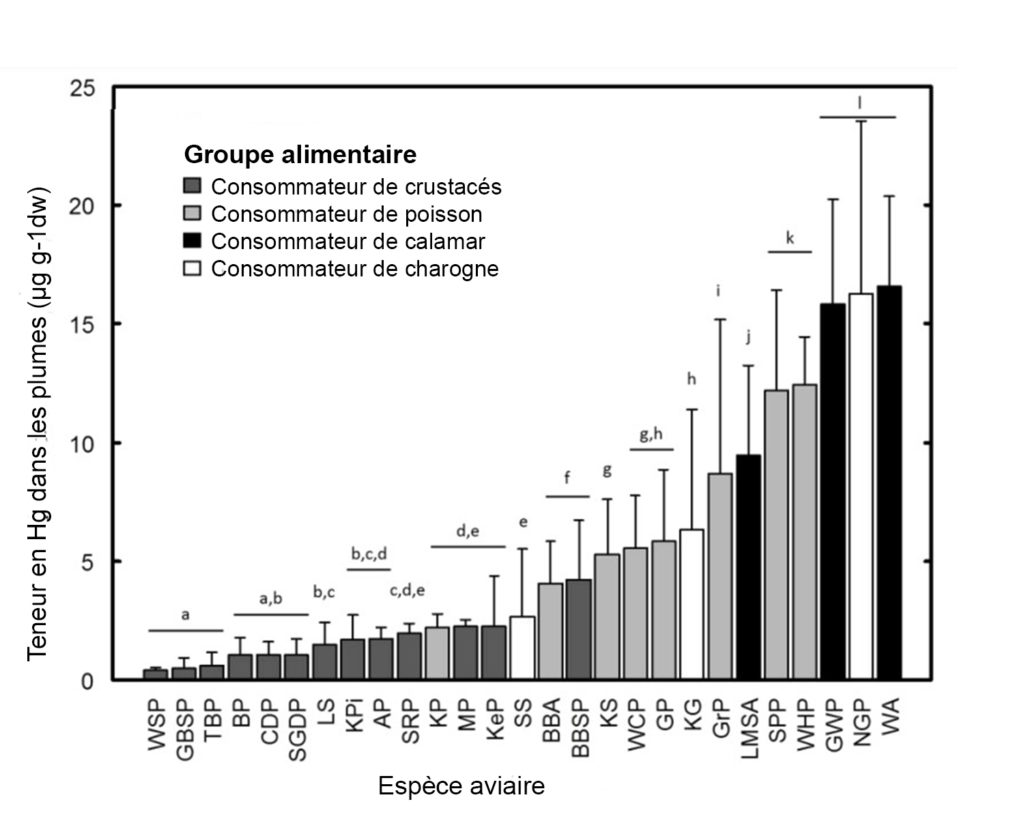
Les espèces côtières se nourrissant d’organismes benthiques peuvent avoir des concentrations en mercure élevées. Cela s’explique par la biodisponibilité élevée du mercure dans les environnements benthiques, à cause de la production de MeHg dans les sédiments marins côtiers. La concentration en MeHg atteint son maximum dans les eaux mésopélagiques, entraînant la contamination des proies.
Un ratio Hg/Se élevé s’observe chez les oiseaux à une haute position trophique. Le mercure est connu pour sa capacité à être bioaccumulé tout au long de la chaîne alimentaire. Par conséquent, un prédateur aura un plus haut risque de contamination qu’un consommateur primaire. De plus, comme précédemment expliqué, il semblerait que le mécanisme de détoxication du Hg par le Se ne peut avoir lieu qu’une fois un haut ratio de Se:Hg atteint.

Une étude de Belzile et al. en 2005 démontre que le facteur d’enrichissement (en Hg, MeHg et Se) chez les consommateur primaires étaient de 120 pour le phytoplancton et 280 pour les amphipodes. Les consommateurs secondaires atteindraient des valeurs de 2580 chez la perche et les grands prédateurs comme le doré jaune (Sander vitreus) arrivent à atteindre un facteur de 11 200. Ce facteur d’enrichissement augmentant tout au long de la chaîne trophique, on peut supposer la continuité jusqu’aux grands prédateurs que sont les oiseaux marins.
Le mot de la fin
Le mécanisme de détoxication du mercure par le sélénium est possible grâce à la forte affinité du méthylmercure pour le sélénium, formant ainsi du séléniure de mercure. De nombreuses études ont prouvé que la quantité de mercure accumulée, et donc le ratio Hg:Se, était influencé par la position trophique des individus. Plus un consommateur est à un haut niveau, plus ses proies ont pu être contaminées. Néanmoins, les rapports Hg:Se peuvent évoluer selon le degré de contamination du lieu où les oiseaux se nourrissent. De plus, le ratio Hg:Se est susceptible de varier au cours des saisons. L’étude de Rutkowska et al. de 2019 montre que chez le pingouin Torda (Alca torda), les concentrations en MeHg sont significativement plus élevées en hiver. Cette différence peut être expliquée par la mue, et par l’utilisation des réserves énergétiques entraînant, par exemple, une diminution de la taille foie et donc une plus grande concentration en mercure. Une autre possibilité de détoxication du Hg est la transmission de la mère à l’œuf. . Enfin, les migrations sont également un facteur de variation du ratio Hg:Se. Les espèces visitant les eaux subtropicales hors période de reproduction ont tendance à concentrer plus de Hg que celles qui restent dans l’océan Austral toute l’année.
Les variations saisonnières de ce rapport sont encore trop peu étudiées mais sont un axe essentiel à aborder pour mieux comprendre et appréhender ces mécanismes de détoxication. De plus, le sélénium ne se lie pas uniquement avec le mercure, mais également avec d’autres métaux comme le plomb, le fer, le cuivre ou encore le zinc. Il serait donc intéressant d’aborder l’ensemble de ces mécanismes.
Glossaire
1Ligand : Atome, ion ou une molécule capable de se lier à un ou plusieurs atomes ou ions.
2Groupements thiols : Composé organique impliqué dans la captation des métaux lourds.
3Protéines sulfhydryle-cystéine (–SH) : Protéines capables de capter les métaux lourds.
4Métaboliser : Transformer une substance au cours du métabolisme.
5Méthylation : Association d’une molécule avec un groupe méthyl (CH3).
6Atrésie : Malformation congénitale menant à une anomalie anatomique qui se caractérise par la fermeture complète ou non d’un orifice ou d’un conduit d’un organisme.
7Métallothionéines : Protéines ayant une haute affinité pour les ions métalliques. Elles sont présentes chez tous les animaux.
8Homéostasie : Capacité d’un système à maintenir l’équilibre de son milieu intérieur, quelles que soient les contraintes externes.
9Neurotoxine : Substance toxique élaborée par un être vivant, agissant sur le système nerveux.
Pour en savoir (beaucoup) plus
Belzile, N., Chen, Y. W., Gunn, J. M., Tong, J., Alarie, Y., Delongchamp, T., & Lang, C. Y. . 2006. The effect of selenium on mercury assimilation by freshwater organisms. Canadian Journal of Fisheries and Aquatic Sciences, 63(1), 1–10.
Bustamante, P., Lahaye, V., Durnez, C., Churlaud, C., Caurant, F., 2006. Total and organic Hg concentrations in cephalopods from the North Eastern Atlantic waters: influence of geographical origin and feeding ecology. Sci. Total Environ. 368, 585e596.
Carravieri, A., Cherel, Y., Blévin, P., Brault-Favrou, M., Chastel, O., & Bustamante, P. 2014. Mercury exposure in a large subantarctic avian community. Environmental Pollution, 190, 51–57.
Cherel, Y., Barbraud, C., Lahournat, M., Jaeger, A., Jaquemet, S., Wanless, R. M., Bustamante, P. 2018. Accumulate or eliminate? Seasonal mercury dynamics in albatrosses, the most contaminated family of birds. Environmental Pollution, 241, 124–135
Hutton, M. .1981. Accumulation of heavy metals and selenium in three seabird species from the United Kingdom. Environmental Pollution. Series A, Ecological and Biological, 26(2), 129–145.
L’auteure

Julia est en quatrième année d’étude de biologie marine. Souhaitant s’orienter dans la recherche pour le domaine aquacole elle est en alternance au sein de la plateforme Mollusque Marins de l’IFREMER. Elle est également la co-présidente de l’association KrillAdélie qui diffuse des vidéos de vulgarisation scientifique sur le thème de la gestion des ressources halieutiques et de la biodiversité.